Μια καινοτόμος θεραπευτική προσέγγιση που έχει αναπτυχθεί από ερευνητές του ΜΙΤ και του Πανεπιστημίου Στάνφορντ υπόσχεται να επαναστατήσει την αντιμετώπιση του καρκίνου, εστιάζοντας σε έναν από τους πιο ύπουλους μηχανισμούς άμυνας των όγκων: το «ζαχαρένιο» καμουφλάζ τους. Αυτή η νέα μέθοδος δεν περιορίζεται στην απλή ανίχνευση των καρκινικών κυττάρων, αλλά τα «γδύνει» από την προστατευτική τους επικάλυψη, επιτρέποντας στο ανοσοποιητικό σύστημα να επιτεθεί με πρωτοφανή αποτελεσματικότητα.
Η αόρατη απειλή και το «φρένο» του ανοσοποιητικού συστήματος
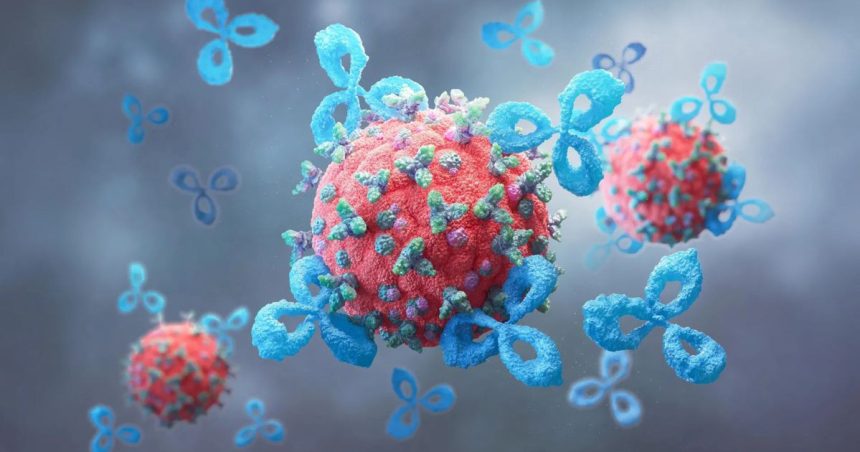
Εδώ και δεκαετίες, η επιστημονική κοινότητα γνωρίζει πως τα καρκινικά κύτταρα είναι εξαιρετικοί στην απόκρυψη. Ένας από τους κύριους τρόπους που το επιτυγχάνουν είναι μέσω των γλυκανών, ειδικών μορίων σακχάρου που καλύπτουν την επιφάνειά τους. Αυτά τα σάκχαρα, όπως το σιαλικό οξύ, λειτουργούν ως διακόπτης απενεργοποίησης για τα ανοσοκύτταρα.
Όταν τα ανοσοκύτταρα πλησιάζουν τον όγκο, οι υποδοχείς τους (γνωστοί και ως Siglecs) συνδέονται με το σιαλικό οξύ των καρκινικών κυττάρων. Αυτή η ένωση στέλνει ένα σήμα παύσης, πείθοντας ουσιαστικά τον οργανισμό ότι ο εισβολέας είναι φιλικός ή ακίνδυνος. Αυτός ο μηχανισμός λειτουργεί όπως ένα φυσικό «φρένο», παρόμοιο με εκείνο που στοχεύουν οι σύγχρονες ανοσοθεραπείες, όπως οι αναστολείς PD-1/PD-L1, αλλά χρησιμοποιεί εντελώς διαφορετικά μονοπάτια.
AbLecs: Ο Δούρειος Ίππος της βιοτεχνολογίας
Εδώ ξεκινά η επανάσταση της ομάδας με επικεφαλής την Jessica Stark από το MIT και την Carolyn Bertozzi από το Στάνφορντ. Οι ερευνητές δημιούργησαν μια νέα κατηγορία υβριδικών μορίων με την ονομασία “AbLecs“.
Η ιδέα πίσω από τα AbLecs είναι απλή αλλά εξαιρετικά περίπλοκη στην εφαρμογή της: το μόριο λειτουργεί ως διπλός πράκτορας. Το τμήμα του αντισώματος αναλαμβάνει την πλοήγηση, εντοπίζοντας με ακρίβεια τον όγκο, όπως κάνουν οι στοχευμένες θεραπείες σήμερα. Μόλις φτάσει στον στόχο, η λεκτίνη αναλαμβάνει δράση, προσδεδεμένη στα σάκχαρα του καρκινικού κυττάρου, μπλοκάροντας το σιαλικό οξύ.
Έτσι, το καρκινικό κύτταρο δεν μπορεί πια να χρησιμοποιήσει το σιαλικό οξύ για να απενεργοποιήσει τα ανοσοκύτταρα. Το «φρένο» αχρηστεύεται, και το ανοσοποιητικό σύστημα δύναται να αναγνωρίσει τον εχθρό και να εξαπολύσει επίθεση μέσω μακροφάγων και φυσικών κυττάρων φονέων (NK cells).
Ξεπερνώντας τα εμπόδια του παρελθόντος
Η προσπάθεια στόχευσης των γλυκανών αν και δεν είναι νέα, είχε μέχρι πρόσφατα περικλείσει ένα κρίσιμο εμπόδιο. Οι λεκτίνες, από μόνες τους, δεν προσκολλώνται αρκετά δυνατά για να μείνουν στην επιφάνεια των καρκινικών κυττάρων. Η καινοτομία των AbLecs επιλύει αυτό το ζήτημα χρησιμοποιώντας το αντίσωμα ως «όχημα μεταφοράς», το οποίο φέρνει τη λεκτίνη ακριβώς όπου χρειάζεται και την κρατάει στη θέση της.
Σύμφωνα με πειράματα που δημοσιεύθηκαν στο Nature Biotechnology, η ομάδα χρησιμοποίησε το φάρμακο τραστουζουμάμπη (γνωστό για τη θεραπεία του καρκίνου του μαστού) ως βάση για το AbLec. Τα αποτελέσματα ήταν εντυπωσιακά: σε ποντίκια με μεταστατικούς όγκους στους πνεύμονες, η νέα θεραπεία περιόρισε την ανάπτυξη των όγκων πολύ πιο αποτελεσματικά από ότι έκανε το αντίσωμα μόνο του.
Μια «plug-and-play» πλατφόρμα για κάθε ασθενή
Ένα από τα πιο συναρπαστικά στοιχεία της ανακάλυψης είναι η ευελιξία της. Η Jessica Stark περιγράφει τα AbLecs ως «αρθρωτά» (modular). Αυτό σημαίνει ότι οι επιστήμονες έχουν τη δυνατότητα να αλλάζουν τα συστατικά του μορίου ανάλογα με τις ανάγκες του ασθενούς. Μπορούν να αντικαθιστούν το αντίσωμα για να στοχεύουν διαφορετικούς τύπους καρκίνου, όπως με το rituximab ή το cetuximab, ή να τροποποιούν τη λεκτίνη για να μπλοκάρουν διαφορετικούς τύπους σακχάρων.
Αυτή η προσαρμοστικότητα ανοίγει τον δρόμο για εξατομικευμένες θεραπείες που θα μπορούσαν να είναι αποτελεσματικές εκεί που οι τρέχουσες μέθοδοι αποτυγχάνουν. Είναι γνωστό άλλωστε ότι πολλοί ασθενείς δεν ανταποκρίνονται στους υπάρχοντες αναστολείς σημείων ελέγχου.
Το μέλλον της Valora Therapeutics
Η τεχνολογία αυτή δεν πρόκειται να παραμείνει στα εργαστήρια, καθώς οι ερευνητές έχουν ήδη ιδρύσει την επιχείρηση βιοτεχνολογίας Valora Therapeutics, με σκοπό να μετατρέψουν αυτήν την ανακάλυψη σε κλινικά εφαρμόσιμο φάρμακο. Το χρονοδιάγραμμα προβλέπει την έναρξη κλινικών δοκιμών σε ανθρώπους μέσα στα επόμενα δύο με τρία χρόνια.
Αν και η διαδικασία προς την τελική έγκριση είναι μακρά, αυτή η προσέγγιση τονίζει πώς η βαθύτερη κατανόηση της χημείας του καρκίνου μπορεί να οδηγήσει σε πιο αποτελεσματικά όπλα. Αντί να προσπαθούμε απλώς να καταστρέψουμε τον όγκο, μαθαίνουμε πώς να του αφαιρούμε τα εργαλεία που χρησιμοποιεί για να επιβιώσει. Η εξάλειψη της «ασπίδας» ζάχαρης μπορεί να αποδειχθεί το κλειδί για το μέλλον της σύγχρονης ογκολογίας.

![Stranger Things - Review του φινάλε [με spoilers!]](https://techreport.gr/wp-content/uploads/2026/01/Απίστευτο-Φινάλε-του-Stranger-Things-Όλα-τα-Μυστικά-και-οι-150x150.jpg)









